Materia
Nivel de organización de la materia
- A nivel biológico
- A nivel de la materia
Estas partículas son
más pequeñas que el átomo de una sustancia. Los protones, neutrones y
electrones son las principales partículas subatómicas que residen en una
sustancia. Los protones son partículas cargadas positivamente y los
neutrones carecen de carga. Estos residen dentro del núcleo del
átomo. Los electrones son partículas cargadas negativamente y giran
alrededor del núcleo en ciertos niveles de energía o capas. El fotón es
también una partícula subatómica. Un fotón es un cuanto de energía
electromagnética, que posee cero masa y energía de reposo y se mueve con la
velocidad de la luz.
Los átomos se definen
como la unidad más pequeña o los bloques de construcción básicos de la materia
que conforman todos los objetos. Los átomos están compuestos por un número
igual de protones y electrones. Sin embargo, puede haber una diferencia en
el número de neutrones entre dos átomos del mismo elemento. El centro del
átomo está ocupado por lo que se conoce como el núcleo; Consta de los
protones y neutrones. Los electrones, como se mencionó anteriormente,
siguen orbitando alrededor del núcleo.
Moléculas pequeñas
Las moléculas más
grandes están formadas por algunos bloques de construcción y estos bloques se
atribuyen como moléculas pequeñas. Ejemplos de tales moléculas son
aminoácidos, ácidos grasos, glucosa, etc.
Macromoléculas
Consistentes en muchas
subunidades, las macromoléculas se definen como moléculas grandes o gigantescas
que pueblan una célula y representan las funciones importantes de la
vida. Los ejemplos son carbohidratos, lípidos, proteínas, ácidos
nucleicos, etc.
Asambleas Moleculares
Estos conjuntos son
conjuntos organizados que comprenden una o más entidades moleculares. Los
microtúbulos (cintas transportadoras dentro de las células) y la membrana
celular (membrana plasmática) son un ejemplo típico de ensamblajes moleculares
organizados.
Organelas
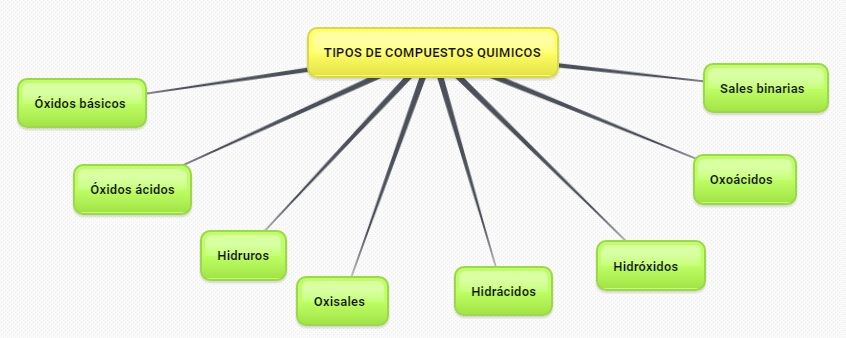
Clasificación de los compuestos químicos
Sustancias compuestas o compuestos



Información obtenida de contenidos digitales, para más información click aquí
Tabla Periódica
Conocer la tabla periódica Aquí



El hidrógeno (H) y el helio (He) son elementos especiales. El hidrógeno , en su forma neutra, no tiene un neutrón. Solo hay un electrón y un protón. Probablemente no encuentre hidrógenos atómicos flotando por sí mismos. El hidrógeno atómico quiere combinarse con otros elementos para llenar su capa exterior. Su química trabajo utilizará más hidrógeno molecular (H 2 ) o iones de hidrógeno (H + , protones).
El helio (He) es diferente de todos los otros elementos. Es muy estable con solo dos electrones en su orbital externo (capa de valencia). Aunque solo tiene dos electrones, todavía está agrupado con los gases nobles.que tienen ocho electrones en sus orbitales más externos. Los gases nobles y el helio son todos "felices", porque su capa de valencia está llena.
Estados de la materia
 Digamos
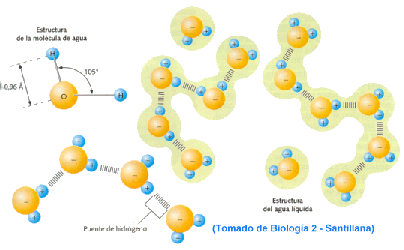
que tienes un vaso de agua (H 2 O). Cuando la temperatura del
agua sube, las moléculas se excitan más y rebotan mucho más. Si le das suficiente
energía a una molécula de agua líquida , ésta se escapa de la fase
líquida y se convierte en gas . La energía extra permite
que las moléculas cambien de estado.
Digamos
que tienes un vaso de agua (H 2 O). Cuando la temperatura del
agua sube, las moléculas se excitan más y rebotan mucho más. Si le das suficiente
energía a una molécula de agua líquida , ésta se escapa de la fase
líquida y se convierte en gas . La energía extra permite
que las moléculas cambien de estado.
 Un
océano líquido
Un
océano líquido
 Los
globos no son técnicamente gases. Son pequeños trozos de goma. Sin
embargo, el helio (He) dentro del globo es un gas. El
helio es un gas noble que tiene una masa atómica muy baja. En su
estado gaseoso, es más ligero que el aire. Los átomos de helio tienen una
masa más baja que las moléculas de nitrógeno (N 2 ) y
oxígeno (O 2 ) que llenan la mayor parte de nuestro aire. La
masa inferior y la ligereza ayudan a los globos a flotar.
Los
globos no son técnicamente gases. Son pequeños trozos de goma. Sin
embargo, el helio (He) dentro del globo es un gas. El
helio es un gas noble que tiene una masa atómica muy baja. En su
estado gaseoso, es más ligero que el aire. Los átomos de helio tienen una
masa más baja que las moléculas de nitrógeno (N 2 ) y
oxígeno (O 2 ) que llenan la mayor parte de nuestro aire. La
masa inferior y la ligereza ayudan a los globos a flotar.
1) https://conceptodefinicion.de/materia/
2) https://www.monografias.com/trabajos97/materia-monografia/materia-monografia.shtml
3) https://concepto.de/que-es-la-materia/
4) http://www.profesorenlinea.cl/fisica/Materia1.htm
5) http://newton.cnice.mec.es/materiales_didacticos/materia/index.html
El término
"orgánulo" significa pequeños órganos y es una parte especializada de
una célula. Al igual que el cuerpo humano que tiene órganos como el
corazón, el hígado, etc., una célula también los tiene en forma de orgánulo. Algunos
ejemplos son el núcleo, el retículo endoplásmico, las mitocondrias, etc.
De aquí en adelante comienza a nivel biológico.
Los compuestos químicos
generalmente pueden clasificarse en dos grandes grupos: compuestos moleculares
y compuestos iónicos. Los compuestos moleculares involucran átomos unidos por
enlaces covalentes y pueden representarse mediante una variedad de fórmulas.
Los compuestos iónicos están compuestos de iones unidos por enlaces iónicos, y
sus fórmulas generalmente se escriben usando estados de oxidación.

Los compuestos
moleculares están compuestos de átomos que se mantienen unidos por enlaces
covalentes. Estos enlaces se forman cuando los electrones se comparten entre
dos átomos. El concepto de fórmulas químicas se creó para describir muchas
características de compuestos moleculares de una manera sencilla. Una fórmula
química normal abarca factores tales como qué elementos están en la molécula y
cuántos átomos de cada elemento hay. El número de átomos de cada elemento se
denota mediante un subíndice, un pequeño número que se escribe a la izquierda
del elemento.
Sustancias compuestas o compuestos

Son
las sustancias formadas por dos o más clases de átomos (es decir por dos o más
elementos diferentes). La mayoría de las sustancias son compuestos. Por
ejemplos: el cloruro de sodio (NaCl), el agua (H2O), el dióxido de
carbono (CO2), hidróxido de sodio (NaOH), el ácido sulfúrico (H2SO4),
el bicarbonato de sodio (NaHCO3), etc.
Clasificación de los compuestos
Los
compuestos pueden ser clasificados de distintas maneras:
1.- Según el número
de elementos diferentes que hay en su fórmula química se clasifican en
Compuestos binarios, ternarios y cuaternarios. Así, por ejemplo, el NaCl, el H2O
y el CO2 son compuestos binarios; el NaOH y el H2SO4 son
compuestos ternarios y el NaHCO3 es un compuesto cuaternario.
2.- Teniendo en
cuenta las clases de elementos que lo constituyen, se clasifican en compuestos
orgánicos y compuestos inorgánicos, aún cuando esta división no es taxativa.
a) Compuestos orgánicos
Estos compuestos se caracterizan porque en su fórmula
química siempre se encuentra presente el elemento carbono, combinado con otros
elementos que pueden ser hidrógeno, oxígeno, nitrógeno y/o azufre. Son
estudiados detalladamente por la Química Orgánica (también llamada Química del
Carbono). El nombre de “orgánicos” proviene de la antigua creencia de que estas
sustancias solo podían obtenerse de los seres vivos.

Los químicos orgánicos estudian la estructura de las
moléculas orgánicas, sus propiedades químicas y métodos de síntesis.
Los hidratos de carbono, los alcoholes, las proteínas, las
grasas, las vitaminas, la mayoría de los medicamentos, etc. son compuestos
orgánicos. Las siguientes sustancias: metano (CH4), propano (C3H8),
butano (C4H10), etanol (CH3-CH2OH),
acetileno (C2H4), benceno (C6H6),
anilina (C6H5NH2), ácido acético (CH3-COOH),
etc., son ejemplos de compuestos orgánicos.
Por conveniencia, algunos compuestos que contienen carbono,
tales como monóxido de carbono (CO), dióxido de carbono (CO2), disulfuro
de carbono (CS2), cianuros (CN)-, carbonatos (CO3)-2 etc.,
son incluidos dentro de los compuestos inorgánicos.
b) Compuestos inorgánicos
Dentro de este grupo se incluyen todos los compuestos que
no poseen el elemento carbono en su fórmula química, con las excepciones arriba
mencionadas.
3.- Considerando el tipo de unión entre
los átomos que forman los compuestos, se clasifican en compuestos covalentes y
compuestos iónicos.
Clasificación de los compuestos inorgánicos
Los compuestos inorgánicos se suelen clasificar en
binarios, ternarios y cuaternarios, según estén formados por dos, tres o cuatro
elementos respectivamente.
1.- Compuestos
binarios
2.- Compuestos ternarios Hidróxidos Oxoácidos Oxisales
3.- Compuestos cuaternarios Sales ácidas Sales básicas
2.- Compuestos ternarios Hidróxidos Oxoácidos Oxisales
3.- Compuestos cuaternarios Sales ácidas Sales básicas
Información obtenida de contenidos digitales, para más información click aquí
Tabla Periódica
Conocer la tabla periódica Aquí
Elementos como bloques de construcción
La tabla periódica está
organizada como una gran cuadrícula. Cada elemento se coloca
en una ubicación específica debido a su estructura atómica. Al igual que
con cualquier cuadrícula, la tabla periódica tiene filas (de izquierda a
derecha) y columnas (arriba y abajo). Cada fila y columna tiene
características específicas. Por ejemplo, el magnesio (Mg)
y el calcio (Mg) se encuentran en la
columna dos y comparten ciertas similitudes, mientras que el potasio (K)
y el calcio (Ca) de la fila cuatro
comparten características diferentes. El magnesio y el sodio(Na)
también comparten cualidades porque están en el mismo período (configuraciones
electrónicas similares).
Tiene sus periodos ...
A pesar de que saltan algunos cuadrados en el medio, todas las filas se
leen de izquierda a derecha. Cuando observa la tabla periódica, cada fila
se denomina punto. Todos
los elementos en un período tienen el mismo número de orbitales
atómicos . Por ejemplo, cada elemento en la fila superior (el primer
período) tiene un orbital para sus electrones . Todos los
elementos en la segunda fila (el segundo período) tienen dos orbitales para sus
electrones. A medida que avanzas por la tabla, cada fila agrega un
orbital. En este momento, hay un máximo de siete orbitales de electrones.
... y sus grupos
Ahora
sabe acerca de los períodos que van de izquierda a derecha. La tabla
periódica también tiene un nombre especial para sus columnas
verticales. Cada columna se llama un grupo. Los elementos de cada grupo
tienen el mismo número de electrones en el orbital externo . Esos
electrones externos también se llaman electrones de valencia . Son los
electrones involucrados en enlaces químicos con otros elementos.
Cada elemento de la primera columna (grupo uno) tiene un electrón en su capa externa. Cada elemento en la segunda columna (grupo dos) tiene dos electrones en la capa externa. A medida que continúe contando las columnas, sabrá cuántos electrones hay en la capa exterior. Hay excepciones al orden cuando miras los elementos de transición, pero tiene la idea general. Los elementos de transición agregan electrones al segundo orbital último.
Por ejemplo, el nitrógeno (N) tiene el número atómico siete. El número atómico te dice que hay siete electrones en un átomo neutro de nitrógeno. ¿Cuántos electrones hay en su orbital externo? El nitrógeno se encuentra en la quinceava columna, etiquetada como 'Grupo VA'. La 'V' es el número romano para cinco y representa el número de electrones en el orbital externo. Toda esa información le dice que hay dos electrones en el primer orbital y cinco en el segundo (2-5).
El fósforo (P) también está en el Grupo VA, lo que significa que también tiene cinco electrones en su orbital externo. Sin embargo, debido a que el número atómico del fósforo es quince, la configuración electrónica es 2-8-5.
Cada elemento de la primera columna (grupo uno) tiene un electrón en su capa externa. Cada elemento en la segunda columna (grupo dos) tiene dos electrones en la capa externa. A medida que continúe contando las columnas, sabrá cuántos electrones hay en la capa exterior. Hay excepciones al orden cuando miras los elementos de transición, pero tiene la idea general. Los elementos de transición agregan electrones al segundo orbital último.
Por ejemplo, el nitrógeno (N) tiene el número atómico siete. El número atómico te dice que hay siete electrones en un átomo neutro de nitrógeno. ¿Cuántos electrones hay en su orbital externo? El nitrógeno se encuentra en la quinceava columna, etiquetada como 'Grupo VA'. La 'V' es el número romano para cinco y representa el número de electrones en el orbital externo. Toda esa información le dice que hay dos electrones en el primer orbital y cinco en el segundo (2-5).
El fósforo (P) también está en el Grupo VA, lo que significa que también tiene cinco electrones en su orbital externo. Sin embargo, debido a que el número atómico del fósforo es quince, la configuración electrónica es 2-8-5.
Dos en la cima
El hidrógeno (H) y el helio (He) son elementos especiales. El hidrógeno , en su forma neutra, no tiene un neutrón. Solo hay un electrón y un protón. Probablemente no encuentre hidrógenos atómicos flotando por sí mismos. El hidrógeno atómico quiere combinarse con otros elementos para llenar su capa exterior. Su química trabajo utilizará más hidrógeno molecular (H 2 ) o iones de hidrógeno (H + , protones).
El helio (He) es diferente de todos los otros elementos. Es muy estable con solo dos electrones en su orbital externo (capa de valencia). Aunque solo tiene dos electrones, todavía está agrupado con los gases nobles.que tienen ocho electrones en sus orbitales más externos. Los gases nobles y el helio son todos "felices", porque su capa de valencia está llena.
Estados de la materia
Nos fijamos
en cinco estados de la materia en
el sitio. Los sólidos, líquidos, gases, plasmas y condensados de
Bose-Einstein (BEC) son diferentes estados de la materia que tienen diferentes
propiedades físicas. Los sólidos a menudo son duros, los líquidos llenan
los contenedores y los gases nos rodean en el aire. Cada uno de estos
estados también se conoce como una fase .
¿Cómo
cambia la materia de un estado a otro? Los elementos y compuestos pueden
moverse de un estado a otro cuando cambian las condiciones físicas específicas . Por
ejemplo, cuando la temperatura de un
sistema aumenta, la materia en el sistema se vuelve más excitada y activa. Si
se introduce suficiente energía en un sistema, puede ocurrir un cambio de fase
a medida que la materia se mueve a un estado más activo.
¿Alguna
vez has notado que puedes oler una cena de pavo después de que comienza a
calentarse? A medida que la energía de las moléculas en el interior del
pavo se calienta, escapan como un gas. Eres capaz de oler los compuestos volátiles que se
mezclan en el aire a tu alrededor.
Se
trata de lo físico
Cambiar
la presión de un
sistema es otra forma de crear un cambio físico. Si coloca un vaso de agua
líquida en una mesa, simplemente se sentará allí. Si coloca un vaso de
agua en una cámara de vacío y
baja la presión, puede comenzar a observar cómo hierve el agua y las moléculas
de agua pasan a una fase gaseosa.
Cuando
las moléculas se mueven de una fase a otra, siguen siendo la misma sustancia. Hay
agua Vapor encima de una
olla de agua hirviendo. Ese vapor (o gas) puede condensarse y
convertirse en una gota de agua líquida en el aire más frío. Si pones esa
gota de líquido en el congelador, se convertirá en un pedazo sólido de hielo. No
importa en qué estado físico se encuentre, siempre fue agua. A pesar de
que el estado físico cambió, las propiedades químicas eran las mismas.
Por
otro lado, un cambio químico construiría o rompería los enlaces químicos en las moléculas
de agua (H 2 O). Si añadieras un átomo de carbono (C),
crearías formaldehído (H 2 CO). Si agrega un átomo de oxígeno (O),
creará peróxido de hidrógeno (H 2 O 2). Ninguno de los
compuestos nuevos es similar a la molécula de agua original. Generalmente,
los cambios en el estado físico no conducen a ningún cambio químico en los
compuestos.
Estados
de la materia ejemplos
Hay
muchos líquidos a tu alrededor. Océanos, lagos y ríos son buenos ejemplos
de agua líquida (H 2 O). Los científicos planetarios están
buscando otros planetas que tengan agua líquida, pero los planetas requieren
condiciones muy específicas para tener agua como la conocemos.
Sólidos
en la cerámica
Cuencos de cerámica
son un gran ejemplo de un sólido. ¿Sabías que las piezas de cerámica
conforman muchos de los objetos encontrados en las civilizaciones antiguas? Los
materiales cerámicos generalmente están hechos de arcilla blanda que se
calienta y luego se enfría lentamente. La arcilla se vuelve muy dura
porque el agua (H 2 O) se elimina y los enlaces químicosdentro de la arcilla
cambian.
Plasmas
en el sol
Los
plasmas son gases altamente energizados que han perdido sus electrones. Las
estrellas, incluido el Sol, están cubiertas de plasma. Los iones de hidrógeno (H) y helio (He) flotan
alrededor del Sol con sus electrones moviéndose
libremente.
Gases
en globos
"Fase"
describe el estado físico de la
materia. La palabra clave a notar es "físico". La materia
solo se mueve de una fase a otra por medios físicos. Si se agrega energía
(aumentando la temperatura ) o si
se quita energía (congelando algo), puede crear un cambio físico.
Bibliografía:
2) https://www.monografias.com/trabajos97/materia-monografia/materia-monografia.shtml
3) https://concepto.de/que-es-la-materia/
4) http://www.profesorenlinea.cl/fisica/Materia1.htm
5) http://newton.cnice.mec.es/materiales_didacticos/materia/index.html











Comentarios
Publicar un comentario